
Proteína eficaz na reciclagem celular
Avanços recentes na pesquisa em química medicinal trouxeram novos insights sobre a interação entre moléculas e proteínas-alvo, um passo crucial no desenvolvimento de fármacos. Segundo um estudo publicado na revista ChemBioChem, além de encontrar moléculas eficazes, é essencial determinar se elas possuem enantiômeros, versões espelhadas que podem influenciar drasticamente sua funcionalidade.
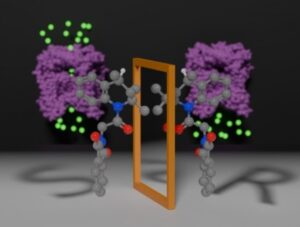
A pesquisa, conduzida por cientistas da Unicamp, Unifesp, UFSCar, UFF e IFSP, explora a ativação da proteína TRPML1, presente na membrana dos lisossomos, estruturas celulares responsáveis pela autofagia, ou “reciclagem celular”. Disfunções nessa proteína estão associadas a doenças como mucolipidose, câncer e maior susceptibilidade a infecções.
Os pesquisadores destacam que a molécula ML-SA1, conhecida por ativar a TRPML1, possui dois enantiômeros, S e R, mas apenas o enantiômero S efetivamente ativa a proteína. A separação dessas formas foi um desafio, exigindo um protocolo inédito desenvolvido com a colaboração de especialistas em cromatografia. A descoberta revela que, em estudos anteriores, a mistura dos enantiômeros pode ter prejudicado a eficácia do composto.
Apesar de promissora, a molécula ML-SA1(S) ainda apresenta limitações, como baixa estabilidade, restringindo seu uso a pesquisas. No entanto, os achados fornecem uma base valiosa para o futuro desenvolvimento de medicamentos que possam induzir a autofagia em humanos, com grande potencial terapêutico.
O estudo, financiado pela FAPESP, CNPq e Capes, destaca a importância de se entender as diferenças funcionais entre enantiômeros, lembrando casos históricos, como o da talidomida, onde a falta de tal conhecimento resultou em consequências trágicas.
Para mais detalhes, o artigo completo está disponível na ChemBioChem
Fonte: Agência FAPESP






Você precisa fazer login para comentar.